
微创创新医疗器械进入特别审批程序
12月6日,上海微创医疗器械(集团)有限公司旗下微创心脉医疗科技(上海)有限公司代理申请的、由英国Lombard Medical研发的产品Altura™腹主动脉覆膜支架系统通过了国家食品药品监督管理总局(CFDA)的审查,进入创新医疗器械特别审批程序,即“绿色通道”。
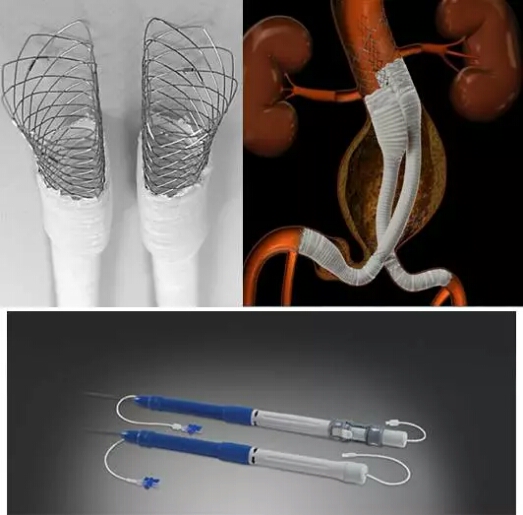
近年来,随着人口老龄化和医疗检测设备的不断改进,腹主动脉瘤(AAA)的发病率和明确诊断率逐年上升。腹主动脉瘤不能自愈,患者若不及时治疗,可因瘤体破裂致死。腹主动脉瘤腔内修复术(EVAR)已成为目前高危AAA的首选疗法。该产品独有的“D”型双腔结构可以实现主动脉覆膜支架在左右肾动脉处不平齐释放,充分利用瘤颈,同时配合肾上裸支架加倒钩的设计,最大程度上降低内漏和移位的发生,为临床医生治疗腹主动脉瘤提供了一个简单、可靠的手术方案。
2015年至今,微创®心脉自主研发的Castor®分支型主动脉覆膜支架及输送系统、Reewarm® PTX药物球囊扩张导管、Minos™ Ultra Low Profile腹主动脉覆膜支架及输送系统、Talos™ 直管型胸主动脉覆膜支架系统四款产品先后进入了创新医疗器械特别审批程序。Altura™是微创®心脉代理申报的首个通过特别审批程序的进口医疗器械产品,这不仅是对该产品自主创新性的肯定,也将加快该产品进入中国市场的步伐。相信Altura™一旦获批上市,将进一步推动我国主动脉腔内修复领域新产品、新技术的应用,使更多的中国腹主动脉瘤患者获益。
